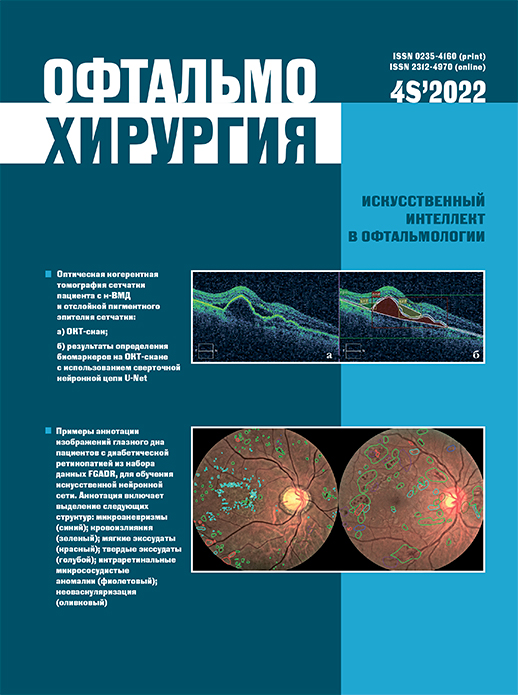
Применение сверточных нейронных сетей для определения эндотелиальной дистрофии Фукса
Ключевые слова:
искусственный интеллект, дистрофия роговицы Фукса, сверточные нейронные сетиАннотация
Цель. Оценить применение сверточных нейронных сетей для автоматического определения дистрофии Фукса.
Материал и методы. Была произведена выборка случайных (n=700) биомикроскопических снимков роговицы, полученных при помощи эндотелиального микроскопа (Tomey EM-3000), из базы данных Санкт-Петербургского филиала «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова». На первом этапе выполнялось разделение снимков на 2 группы. Первая группа включала в себя снимки с наличием дистрофии Фукса, вторая – норму или другую патологию. Снимки плотности эндотелиальных клеток были разделены на три категории: тренировочный, валидационный и тестовый наборы данных. В нашем исследовании были протестированы различные архитектуры сверточных нейронных сетей: ResNet18, ResNet50, VGG16, VGG19 и GoogleNet.
Результаты. В результате апробации нейронной сети на тестовой выборке получены следующие значения F-метрики для различных архитектур нейронных сетей: ResNet18: 0,985; ResNet50: 1,000; VGG16: 0,940; VGG19: 0,990; GoogleNet: 0,987. Сеть ResNet50 показала лучший результат при использовании предобученной сети на данных ImageNet с замороженными слоями, оптимизатором Adam, кросс-энтропией в качестве функции потерь и шагом обучения 0,000005.
Заключение. Применение сверточных нейронных сетей для автоматического определения дистрофии Фукса может быть успешно реализовано в составе системы поддержки принятия решения врача. ResNet50 показала лучшие результаты среди всех типов архитектур и на тестовой выборке не выдала ни одной ошибки, что говорит о высокой эффективности применения данной сети в алгоритме классификации снимков эндотелия роговицы.
Библиографические ссылки
1. Kappor R, Walters SP, Al-Aswad LA. The current state of artificial intelligence in ophthalmology. Surv Ophthalmol. 2019;64(2): 233–240. doi: 10.1016/j.survophthal.2018.09.002
2. Lakhani P, Prater AB, Hutson RK, Andriole KP, Dreyer KJ, Morey J, et al. Machine learning in radiology: applications beyond image interpretation. J Am Coll Radiol. 2018;15(2): 350–359. doi: 10.1016/j.jacr. 2017.09.044
3. Гарри Д.Д., Саакян С.В., Хорошилова-Маслова И.П., Цыганков А.Ю., Никитин О.И., Тарасов Г.Ю. Методы машинного обучения в офтальмологии. Обзор литературы. Офтальмология. 2020;17(1): 20–31. doi: 10.18008/1816-5095-2020-1-20-31 [Garry DD, Sahakyan SV, Khoroshilova-Maslova IP, Tsygankov AYu, Nikitin OI, Tarasov GYu. Machine learning methods in ophthalmology. Literature review. Ophthalmology in Russia. (In Russ.)]
4. Малюгин Б.Э., Сахнов С.Н., Аксенова Л.Е., Мясникова В.В. Применение искусственного интеллекта в диагностике и хирургии кератоконуса: систематический обзор. Офтальмохирургия. 2022;1: 77–96. [Malyugin BE, Sakhnov SN, Aksenova LE, Myasnikova VV. The use of artificial intelligence in the diagnosis and surgery of keratoconus: a systematic review. Fyodorov Journal of Ophthalmic Surgery. 2022;1: 77– 96. (In Russ.)] doi: 10.25276/0235-4160-2022-1-77-96
5. Kotsiantis SB. Supervised machine learning: a review of classification techniques. Informatica. 2007;31: 249–268.
6. Zhang Z. Improved Adam optimizer for deep neural networks. 2018 IEEE/ACM 26th International Symposium on Quality of Service, 2018: 1–2.
7. He K, Zhang X, Ren S, Sun J. Deep residual learning for image recognition. IEEE Conference on computer vision and pattern recognition. 2016: 770 778.
8. Kaiming H. Delving deep into rectifiers: surpassing humanlevel performance on ImageNet classification. 2015 IEEE International Conference on Computer Vision. 2015: 1109–1135.
9. Adamis AP, Filatov V, Tripathi BJ, Tripathi RC. Fuchs’ endothelial dystrophy of the cornea. Surv Ophthalmol. 1993;38(2): 147–168.
10. Friedenwald H, Friedenwald JS. Epithelial dystrophy of the cornea. Br J Ophthalmol. 1925;9(1): 14–20.
11. Fuchs E. Dystrophia epithelialis corneae. Albrecht Von Graefe Arch Klin Exp Ophthalmol. 1910;76: 478–508.
12. Vogt A. Weitere Ergebnisse der Spaltlampenmikroskopie des vorden Bulbusabschnittes. Graefes Arch Clin Exp Ophthalmol.1921;106: 6–103.
13. Cross HE, Maumenee AE, Cantolino SJ. Inheritance of Fuchs’ endothelial dystrophy. Arch Ophthalmol. 1971;85: 268–272.
14. Gottsch JD, Sundin OH, Rencs EV, Emmert DG, Stark WJ, et al. Analysis and documentation of progression of Fuchs corneal dystrophy with retroillumination photography. Cornea. 2006;25(4): 485–489.
15. Rosenblum P, Stark WJ, Maumenee IH, Hirst LW, Maumenee AE. Hereditary Fuchs’ Dystrophy. Am J Ophthalmol. 1980;90: 455–462.
16. Qian N. On the momentum term in gradient descent learning algorithms. Neural Networks: the official journal of the international neural. Neural Networks. 1999;12: 145–151.
17. He K, Zhang X, Ren S, Sun J. Deep residual learning for image recognition. IEEE Conference on computer vision and pattern recognition. 2016: 770–778. doi: 10.1109/CVPR.2016.90
18. Gulshan V, Peng L, Coram M, Stumpe MC, Wu D, et al. Development and validation of a deep learning algorithm for detection of diabetic retinopathy in retinal fundus photographs. JAMA. 2016;316(22): 2402. doi: 10.1001/jama.2016.17216
19. Burlina PM, Joshi N, Pekala M, Pacheco KD, Freund DE, Bressler NM. Automated grading of age-related macular degeneration from color Fundus images using deep convolutional neural networks. JAMA Ophthalmology. 2017;135(11):1170. doi: 10.1001/jamaophthalmol.2017.3782.
20. Raghavendra U, Fujita H, Bhandary SV, Gudigar A, Tan JH, Acharya UR. Deep convolution neural network for accurate diagnosis of glaucoma using digital fundus images. Inform Sci. 2018; 441(1): 41–49. doi: 10.1016/j.ins.2018.01.051
21. Gao X, Lin S, Wong TY. Automatic feature learning to grade nuclear cataracts based on deep learning. IEEE Transactions on Biomedical Engineering. 2015;62(11): 2693–2701. doi: 10.1109/TBME.2015.2444389
22. Ambrósio R, Lopes BT, Faria-Correia F, Salomão MQ, Bühren J, et al. Integration of Scheimpflug-Based corneal tomography and biomechanical assessments for enhancing ectasia detection. J Refract Surg. 2017;33(7): 434–443. doi: 10.3928/1081597X-20170426-02
23. Abràmoff MD, Folk JC, Han DP, Walker JD, et al. Automated analysis of retinal images for detection of referable diabetic retinopathy. JAMA Ophthalmology. 2013;131(3): 351. doi: 10.1001/ jamaophthalmol.2013.1743
24. Abràmoff MD, Lou Y, Erginay A, Clarida W, Amelon R, Folk JC, Niemeijer M. Improved automated detection of diabetic retinopathy on a publicly available dataset through integration of deep learning. Invest Opthalmol Vis Sci. 2016;57(13):5200. doi: 10.1167/iovs.16-19964
25. Takahashi H, Tampo H, Arai Y, Inoue Y, Kawashima H. Applying artificial intelligence to disease staging: deep learning for improved staging of diabetic retinopathy. PLoS One. 2017;12(6): e0179790. doi: 10.1371/ journal.pone.0179790
26. Serrano-Aguilar P, Abreu R, Antón-Canalís L, Guerra-Artal C, Ramallo-Fariña Y, Gómez-Ulla F, Nadal J. Development and validation of a computeraided diagnostic tool to screen for age-related macular degeneration by optical coherence tomography. Br J Ophthalmol. 2011;96(4): 503 507. doi: 10.1136/ bjophthalmol-2011-300660
27. Treder M, Lauermann JL, Eter N. Automated detection of exudative age-related macular degeneration in spectral domain optical coherence tomography using deep learning. Graefes Arch Clin Exp Ophthalmol. 2017;256(2): 259–265. doi: 10.1007/s00417-017-3850-3
Опубликован
Выпуск
Раздел
Категории
Лицензия

Это произведение доступно по лицензии Creative Commons «Attribution-NonCommercial» («Атрибуция — Некоммерческое использование») 4.0 Всемирная.